Produtos Indústria Meios de Cultura

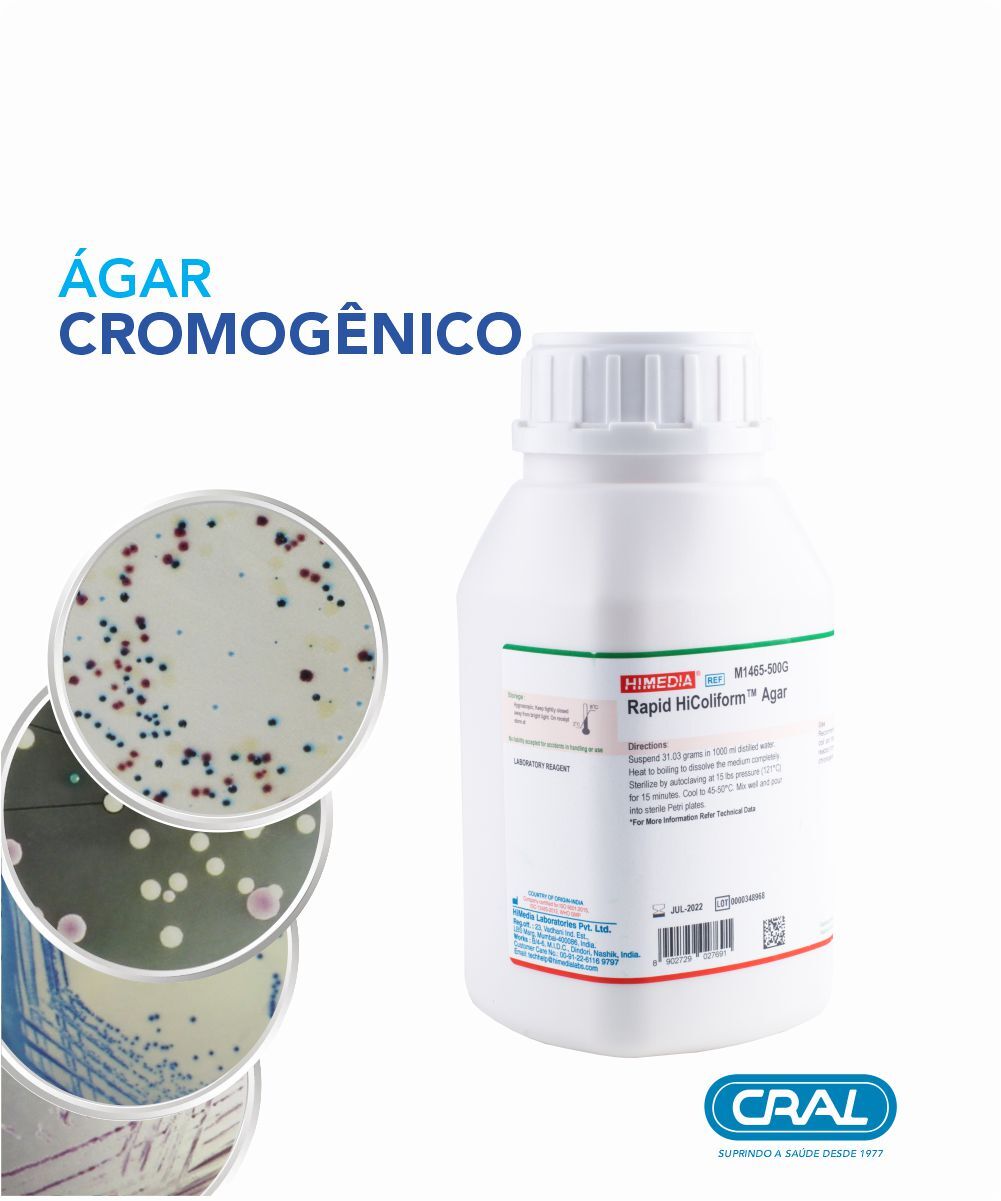
Agar m-endo les frasco 500g
Código: AG-5030
Marca: HIMEDIA
Apresentação: 1 unidade
Meio de cultura liofilizado. Seletivo para coliformes totais em água. Contém lactose e fucsina básica, proporcionando colônias metálicas em E. coli. Utilizado em testes de potabilidade.
Produto considerado não correlato
Informações técnicas do produto
Agar m-endo les frasco 500g
O Ágar M-Endo LES é usado para enumeração de coliformes na água usando um método de filtro de membrana em duas etapas. Composição** Ingredientes Gms / Litro Hidrolisado enzimático de caseína 3.700 Digestão péptica de tecido animal 3.700 Triptose 7.500 Extrato de levedura 1.200 Lactose 9.400 Fosfato dipotássico 3.300 Fosfato monopotássico 1.000 Cloreto de sódio 3.700 Desoxicolato de sódio 0,100 Lauril sulfato de sódio 0,050 Sulfito de sódio 1.600 Fuchsin básico 0,800 Ágar 15.000 PH final (a 25 ° C) 7,2 ± 0,2 ** Fórmula ajustada, padronizada para atender aos parâmetros de desempenho. Instruções: Suspenda 51,05 gramas em 980 ml de água destilada. Aqueça até ferver para dissolver completamente o meio. NÃO AUTOCLAVE. Arrefecer até 45°C e adicionar assepticamente 20 ml de etanol a 95%. Misture e distribua quantidades de 4 ml em placas de Petri de 60 mm. Em grandes placas, use meio suficiente para obter uma profundidade de 1,5 mm. NÃO EXPÕE AS PLACAS À LUZ SOLAR DIRETA. Cuidado: A fucsina básica é um potencial agente cancerígeno e deve-se tomar cuidado para evitar a inalação e a contaminação da pele. Princípio e Interpretação É possível remover bactérias dos fluidos passando-os por filtros com tamanho de poro tão pequeno que as bactérias são presas. Essa técnica de filtragem permite que volumes razoavelmente grandes de água passem rapidamente sob pressão, mas impede a passagem de quaisquer bactérias presentes. Esses nutrientes são retidos na superfície da membrana, que é então colocada em contato com os nutrientes líquidos. Estes se difundem para cima através dos poros, induzindo assim os organismos a crescer como colônias de superfície que pode ser contado (1). O Endo Medium foi desenvolvido pela Endo para diferenciar entre fermentadores de lactose e não fermentadores (2). Estes meios empregaram sulfito de sódio e fucsina básica em vez de sais biliares para obter a inibição de bactérias gram-positivas (2). M-Endo Ágar, LES é uma modificação do meio original e é formulado de acordo com McCarthy et al. Da Estação Experimental de Lawrence (LES) (3) para testar coliformes em água usando um procedimento de filtro de membrana em duas etapas, em que o Caldo de Lauril Sulfato (M080) é usado como o principal meio de enriquecimento. Este meio é recomendado pela APHA para testar coliformes em bebidas e em água engarrafada (4,5). Bactérias coliformes presuntivas formarão colônias vermelhas com brilho metálico após uma incubação a 35-37°C por 24 horas. Hidrolisado enzimático de caseína, triptose, digestão péptica de tecido animal e extrato de levedura fornecem nutrientes essenciais, especialmente nitrogenado para os coliformes. A lactose é o carboidrato fermentável. Sulfito de sódio, desoxicolato de sódio e fucsina básica inibir o crescimento de organismos gram-positivos. Os fosfatos tamponam o meio. Os coliformes fermentam a lactose e os O acetaldeído reage com o sulfito de sódio e a fucsina básica para formar colônias vermelhas e coloração semelhante do meio. Lactose os não fermentadores formam colônias incolores. Na primeira etapa do enriquecimento, a almofada absorvente de algodão é impregnada com Caldo de Lauril Sulfato (M080). Filtro de membrana através do qual a amostra de água é passada é colocada assepticamente sobre ela e incubada sem inverter por 2 horas a 35°C em local úmido atmosfera. Após a incubação, o filtro de membrana é transferido assepticamente para a placa LES do ágar M-Endo e incubado em 35°C por 24 horas. Como alternativa, o filtro de membrana pode ser colocado dentro da tampa da placa de Petri do M-Endo Agar LES e depois impregnado com 2 ml de Caldo de Lauril Sulfato (M080) e incubado por 1 - 1 ½ horas a 35°C. Na segunda etapa, o preparado O filtro de membrana é mantido diretamente na superfície do ágar e incubado como descrito acima. Coliformes presuntivos produzem ouro colônias verdes com brilho metálico dentro de 24 horas após a incubação. Cálculo da densidade coliforme: Observe a densidade coliforme em termos de coliformes totais / 100 ml. Extrapole a contagem usando filtros de membrana com 20-80 colônias coliformes, mas não mais de 200 de todos os tipos por membrana. A fórmula para calcular a contagem é a seguinte: Colônias totais coliformes / 100 ml = colônias coliformes / ml de amostra filtrada x 100. Controle de qualidade Aparência: Pó de fluxo livre homogêneo rosa claro a roxo Gelificação: Firme, comparável com gel de ágar a 1,5% Cor e clareza do meio preparado: Formas de gel ligeiramente opalescente de cor vermelha em placas de Petri Reação: Reação de solução aquosa a 5,1% p/v com álcool a 2%v/v a 25°C. pH: 7,2 ± 0,2 pH: 7.00-7.40 Resposta cultural M1106: Características culturais observadas após uma incubação a 35-37°C por 20-24 horas. Resposta Cultural Organismo:Escherichia coli ATCC 25922 Inoculação: 50-100 Crescimento: Bom-Exuberante Cor da Colônia (em filtro de membrana): Rosa com brilho metálico Organismo: Enterobacter aerogenes ATCC 13048 Inoculação: 50-100 Crescimento: Bom-Exuberante Cor da Colônia (em filtro de memebrana): Rosa a Vermelho, pode ter Brilho Organismo: Salmonella Typhi ATCC 6539 Inoculação: 50-100 Crescimento: Exuberante Cor da Colônia (em filtro de membrana): Incolor a Rosa muito claro Organismo: Staphylococcus aureus ATCC 25923 Inoculação: >=10³ Crescimento: Inibido Cor da Colônia (em filtro de membrana): - Organismo: Klebisiella pneumoniae ATCC 13883 Inoculação: 50-100 Crescimento: Bom-Exuberante Cor da Colônia (em filtro de membrana): Rosa a Vermelho Organismo: Salmonella Typhimurium ATCC 14028 Inoculação: 50-100 Crescimento: Exuberante Cor da Colônia (em filtro de membrana): Incolor a Rosa muito claro Armazenamento e prazo de validade Armazenar abaixo de 30°C em recipiente bem fechado e usar meio preparado na hora. Use antes da data de validade no rótulo. Referências: 1) .Cruickshank R., Duguid J.P., Marmion B.P., Swain R.H.A., (Eds.), Medical Microbiology, 1975, 12a Ed. Vol. II, Churchill Livingstone 2.Endo S., 1904, Zentralbl. Bakteriol. 1, Orig.35: 109-110. 3.McCarthy J. A., Delaney J. E. and Grasso R., 1961, Water and Sewage Works, 108:238. 4.Eaton A. D., Clesceri L. S. e Greenberg A. W., (Eds.), 2005, Métodos Padrão para o Exame de Água e Wastewater, 21st Ed., APHA, Washington, D.C. 5.Fownes F.P. e Ito K., (Eds.), 2001, Compêndio de Métodos para o Exame Microbiológico de Alimentos, 4ª Ed., Associação Americana de Saúde Pública, Washington, D.C.
Informe o lote do produto.
Carregando lotes...